A - Le marquage radioactif des peptides et des protéines : Les deux isotopes radioactifs utilisés pour la fabrication de ligands radiomarqués sont l' iode 125 (125I) et le tritium (3H). A.1 - Le marquage radioactif à l’iode 125 : C'est la méthode la plus utilisée afin d'obtenir un radioligand. Avantages des ligands iodés :
Deux voies majeures d’incorporation du radioélément 125I sont utilisées :
Les différents agents oxydants utilisés :
A.1.1 - Iodation directe du peptide : Il faut que le peptide ou la protéine posséde au moins une tyrosine (ou bien une histidine). NB : On ne décrira ici que le cas le plus fréquent, c'est à dire la iodation d'une chaîne latérale de tyrosine. Iodation sur les résidus de tyrosine : La fixation de l’125I se fait en ortho- du groupement phénolique : 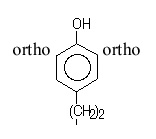 On obtiendra des produits monomarqués (si le peptide possède plusieurs résidus de tyrosine, on parlera d'isomères de position) ainsi que des produits polymarqués. Ces derniers peuvent résulter :
Il faudra à la suite de la réaction de iodation, réaliser une purification chromatographique (le plus souvent par des techniques HPLC) des différents produits de la réaction afin de purifier le dérivé monoiodé possédant les propriétés pharmacologiques désirées. Exemple : Iodation du peptide neurotensine (NT) : Techniques 1 et 2 A.1.2 - Marquage par addition d’un groupement réactif préalablement iodé : L'exemple développé ici concernera un seul réactif, très employé : le réactif de Bolton et Hunter (BH). Marquage par le réactif de Bolton et Hunter : Utilisé lorsque l’incorporation directe de l’iode n’est pas possible :
Réactif de Bolton-Hunter : 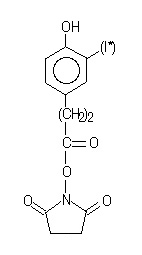 Le réactif de Bolton et Hunter (BH) est un succinimidyl ester de l'acide propionique (N-succinimidyl 3-(4-hydroxyphényl) propionate). Marquage par le réactif de Bolton et Hunter iodé : Ce réactif permet l'acylation des fonctions amines primaires (-NH2) du peptide avec l’ester N-hydroxysuccinimidique de l’acide 3-(4-hydroxyphényl) propionique, marqué par l’iode 125. Dans un peptide, deux sortes de groupements peuvent donc réagir :
L’incorporation aura donc lieu préférentiellement :
Afin de favoriser l’obtention de dérivés marqués en alpha ou bien en epsilon, il est possible de jouer sur le pH réactionnel en milieu aqueux :
Cette technique permet de préserver les propriétés fonctionnelles des peptides dans lesquels l’une des deux fonctions amines est essentielle pour l’expression de l’activité biologique. Exemple : Iodation du peptide neurotensine avec le réactif de Bolton-Hunter iodé : Technique 3 A.1.3 - Inconvénients du marquage à l’iode :
Ces inconvénients font que le marquage des ligands au tritium est parfois une alternative à envisager. A.2 - Le marquage radioactif au tritium : Avantages des ligands tritiés :
Les peptides sont facilement marqués avec du 3H, par deux grands types de méthodes :
A.2.1 - Fixation d’un radical organique de faible taille : Cela permet le marquage des groupements aminés primaires, soit en position a, soit en position e (chaînes latérales des Lysines). Le réactif le plus utilisé est le N-succinimidyl [2,3 3H] propionate. B - Le marquage fluorescent : B.1 - Introduction sur le marquage fluorescent · Les groupements fluorescents sont aussi appelés fluorophores. · La fluorescence est une voie alternative qui offre de nombreux avantages dont surtout l’absence d’exposition à des rayonnements pour les manipulateurs. · La microscopie confocale (coupes optiques de cellules) permet de visualiser les peptides fluorescents liés sur des cellules Site de fixation du fluorophore sur le peptide : On peut séparer les fluorophores en deux groupes, en fonction de leur groupement réactif :
Le complexe peptide-fluorophore doit demeurer hydrophile, ce qui est particulièrement important pour déterminer la localisation des récepteur cellulaires de surface. La taille et la nature du fluorophore vont influer directement sur l’encombrement stérique et l’hydrophobicité de la molécule (modification de l’affinité pour le récepteur) De nombreux fluorophores sont disponibles commercialement :
Toutes ces molécules et leur dérivés vont modifier les fonctions amines des peptides ou des protéines. Exemple 1 : La fluorescéïne et ses dérivés : La fluorescéïne permet d'obtenir un marquage fluorescent vert. Avantages de ce fluorophore :
Inconvénients de ce fluorophore :
Exemple 2 : Les composés de type Bodipy : Bodipy rouge : le Bodipy 576/589 (Molecular Probes) Bodipy vert : le Bodipy 503/512 (Molecular Probes) Exemple 3 : Le Cy 3.5 : Le Cy 3.5 est un dérivé de la cyanine qui réagit comme les dérivés Bodipy et peut être utilisé à la place du Bodipy Rouge 576/589. B.2 - Utilisation des peptides fluorescents : B.2.1 - En remplacement du ligand radioactif dans les expériences de liaison : Dans ce cas, il y a deux techniques pour mesurer l'association du ligand fluorescent avec son récepteur :
B.2.2 - Dans des études de cytométrie de flux : La cytométrie de flux permet le tri des populations de cellules en suspension qui ont été marquées à l'aide d'un ligand ou d'un anticorps fluorescent. B.2.3 - En microscopie en fluorescence : Les peptides fluorescents permettent l’acquisition d’images plus rapidement et avec une plus grande résolution que les peptides radiomarqués (autoradiographie in vitro). La microscopie confocale permet une très bonne résolution des images acquises (et ce sur cellules en culture, coupes fines d’organes, etc). Cette technique de microscopie est ainsi utilisées pour l'étude de la liaison de ligands fluorescents à leurs récepteurs et de l’internalisation du complexe ligand-récepteur, ce qui permet l’identification des compartiments intracellulaires impliqué,s dans l’internalisation. B.2.4 - En hybridation in situ fluorescente : Des sondes oligonucléotidiques ayant incorporé des nucléotides fluorescents sont utilisées. |