Il existe trois grandes familles de récepteurs membranaires : 1 - Les récepteurs à activité enzymatique intrinsèque ou associée 2 - Les canaux ioniques activés par des ligands 3 - Les récepteurs couplés aux protéines-G Les récepteurs couplés aux protéines-G (les RCPGs) : Il existe environ 200 types de RCPGs, sans compter les récepteurs olfactifs couplé aux protéines-G, dont le nombre est à lui seul estimé à 400-1000 récepteurs différents. 1 - Structure des RCPGs : Ces protéines présentent une structure commune à sept hélices alpha transmembranaires : 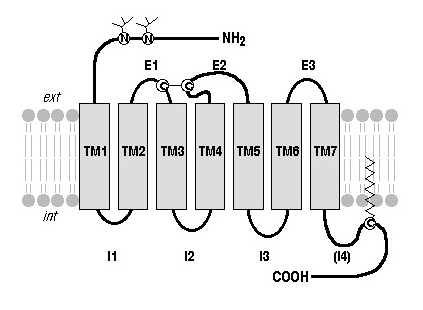 L'extrémité amino-terminale de la protéine est extracellulaire. L'extrémité carboxy-terminale est intracellulaire. On peut observer 3 boucles extracellulaires (nommées E1, E2 et E3) et 3 boucles intracellulaires (I1, I2 et I3). Ces protéines peuvent être sujettes à des modifications post-traductionnelles, de type N-glycosylation, acylation par des composés lipidiques (formant parfois une pseudo-quatrième boucle intracellulaire (I4), formation de ponts disulfures entre les chaînes latérales de 2 résidus de Cystéine... 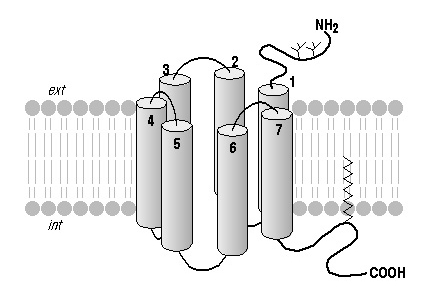 Ces sept domaines transmembranaires sont organisés dans la membrane plasmique et l'on connaît la structure exacte, à une résolution de quelques angstroms, de la rhodopsine, qui est le récepteur visuel des cellules en bâtonnet de la rétine. La rhodopsine est impliquée dans la vision nocturne. 2 - La rhodopsine, le prototype des RCPGS : C'est le premier RCPG à avoir été cloné, en 1984, et ce, chez l'homme. Depuis lors, l'ADNc de cette protéine a été cloné chez de nombreuses espèces animales. 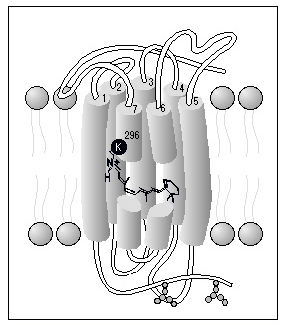
La rhodopsine est un RCPG un peu particulier, dans le sens où c'est un récepteur associé à son ligand.
En effet, une molécule de 11-cis-rétinal est associée de manière covalente à un résidu de lysine du TM VII de la rhodopsine,
et ce, par l'intermédiaire d'une base de Schiff.
C'est l'isomérisation du 11-cis-rétinal en tout-trans-rétinal, induite par un photon, qui entraîne l'activation de la rhodopsine. 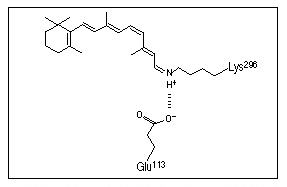 La figure ci-dessous (haut) représente la carte de la densité électronique de la rhodopsine dans une membrane lipidique. De gauche à droite, on peut observer la rhodopsine de boeuf à une résolution de 0,9 nm, et de grenouille à une résolution de 0,7 et 0,6 nm. 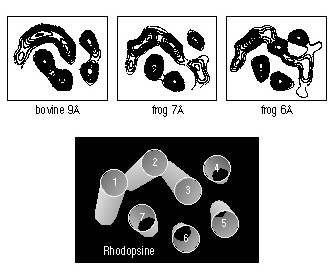 La vue est observée depuis le dessus de la membrane, et de manière perpendiculaire à celle-ci. Une représentation schématique des septs domaines transmembranaires à été déduite de ces études de la densité électronique (bas). Cette étude représente la seule caractérisation disponible à ce jour dans la littérature de la structure d'un RCPG. On ne connaît donc que l'organisation des sept hélices transmembranaires les unes par rapport aux autres, mais l'on ne sait rien des régions intracellulaires et extracellulaires. 3 - Variété des stimuli capables d'activer un RCPG : Des stimuli de nature très variée peuvent activer les RCPGs : - les photons (rhodopsine des bâtonnets et opsines rouge, verte et bleue des cônes) - des ions (Ca++) - des stimuli sensoriels (molécules olfactives, gustatives et phéromones) - des petites molécules endogènes :
- amines (acétylcholine, adrénaline, noradrénaline, dopamine, histamine, mélatonine, sérotonine) - nucléosides (adénosine) et nucléotides (ADP, ATP, UTP) - lipides (anandamide, leucotriènes, Platelet Activating Factor, prostaglandines, thromboxane A2) - peptides endogènes
- peptides d'amphibiens (ranatensine, bombésine)
- les anaphylatoxines C3a et C5a du complément - les peptides N-formylés chimiotactiques
- protéases (thrombine) 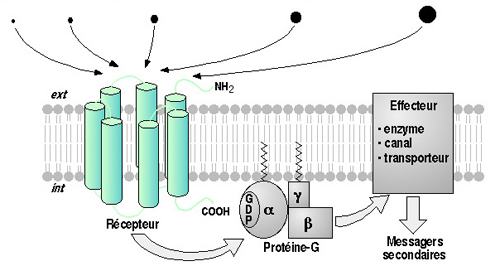 L'activation d'un récepteur couplé aux protéines-G, par son ligand, entraîne un remaniement de la structure du récepteur, qui devient capable d'activer des protéines-G intracellulaires (voir figure ci-dessus). Ces protéines-G activent à leur tour toute une série d'effecteurs intracellulaires (enzymes, canaux ioniques, transporteurs...), membranaires (comme représenté) ou bien cytosoliques. Ces effecteurs permettent la plupart du temps, la modulation de la concentration intracellulaires de messagers secondaires (second messagers) tels l'AMPc, l'IP3, le calcium, les diacyl-glycérols ou DAG...) 4 - Diversité des récepteurs : Variation autour du thème des sept domaines transmembranaires : Il existe environ 150-200 sous-type de récepteurs couplés aux protéines-G qui ont été clonés à ce jour. Ce chiffre est valable si l'on ne tient pas compte des récepteurs olfactifs, qui constituent une famille à part de RCPGs. En effet, le nombre de RCPGs clonés, qui sont impliqués dans la perception des molécules olfactives, est de l'ordre de 400 à 1000. Ce chiffre est énorme puisqu'il représente environ 1-2 % de l'ensemble des gènes du génome des mammifères. On voit bien ici l'importance de cette famille de récepteurs, autant du point de vue du grand nombre de récepteurs, que de la diversité des implication dans les divers processus physiologiques (vision, olfaction, médiation de l'action de nombreuses hormones, de neuropeptides...). 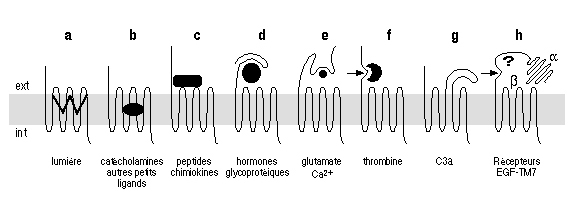 (a) La rhodopsine des cellules en bâtonnet de la rétine, ainsi que les opsines rouge, verte et bleue des cellules en cône, sont activés par des photons, grâce à la présence d'un ligand associé, le 11-cis-rétinal, dérivé de la vitamine A. (b) Les récepteurs de petites molécules telles les catécholamines présentent un site de liaison souvent situé au niveau des régions transmembranaires des récepteurs. (c) Les peptides et les chimiokines sont souvent reconnus au niveau des boucles extracellulaires et de l'extrémité aminoterminale. (d) Le site de liaison des hormones glycoprotéiques se localise dans l'extrémité aminoterminale très longue, de ses récepteurs. (e) L'acide glutamique et le calcium se lient à l'extrémité aminoterminale de leurs récepteurs respectifs. Dans le cas du calcium, ce sont des clusters d'acides aminés chargés négativement qui vont reconnaître le cation. (f) La thrombine active ses récepteurs selon un mode d'action particulier : l'hydrolyse et la libération d'un petit peptide au niveau aminoterminal du récepteur : 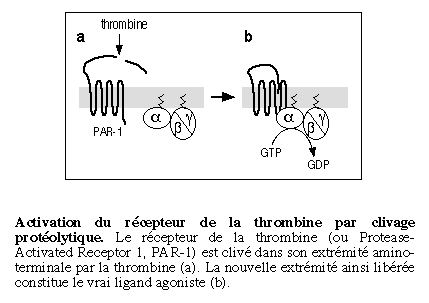 (g) Les récepteurs des anaphylatoxines C3a et C5a du complément ont la particularité de posséder une deuxième boucle extracellulaire très étendue, site d'interaction du ligand avec son récepteur. (h) Les récepteurs de type EGF-TM7 sont des RCPGs hybrides, et semblent être impliqués dans les interactions inter-cellulaires. L'hydrolyse qui interviendrait au niveau aminoterminal serait à l'origine d'un hétérodimère a/b. Techniques de clonages des RCPGs : Plusieurs techniques sont employées pour le clonage des RCPGs. Une technique interessante est l' expression dans l'ovocyte de xénope. 5 - Activation des protéines-G : le cycle GTPase : Le signal apporté par le stimulus extracellulaire est transduit à l'intérieur de la cellule, par l'intermédiaire du récepteur. Le récepteur transmet l'information aux protéines-G intracellulaires, qui à leur tour activent ou inhibent des effecteurs intracellulaires. 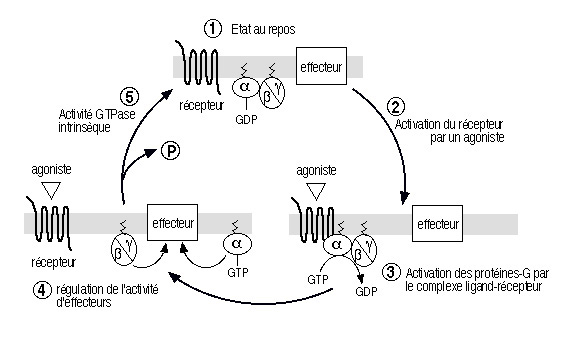 Un RCPG au repos (1) est activé par la liaison d'un agoniste spécifique (2). Le changement de conformation du complexe agoniste-récepteur, induit par cette liaison, permet l'activation de l'échange du GDP par du GTP et donc l'activation de la protéine-G hétérotrimérique (sous-unités Ga et Gb/g) intracellulaires (3) qui vont aller réguler l'activité de divers effecteurs (4) membranaires ou cytosoliques. Le déclenchement de l'activité phosphatase, intrinsèque à la sous-unité Ga entraîne la réassociation des sous-untités Ga et Gb/g (5) et le retour à l'état initial (1). Tant que le récepteur est activé par son ligand, et tant que le système ne subit pas une désensibilisation, le cycle d'échange du GDP par du GTP continue. 6 - Diversité des sous-unités Ga des protéines-G : Les protéines-Ga peuvent être réparties en quatre classes, en fonction des homologies de séquence : Gsa, Gi/oa, Gq/11a et G12a. 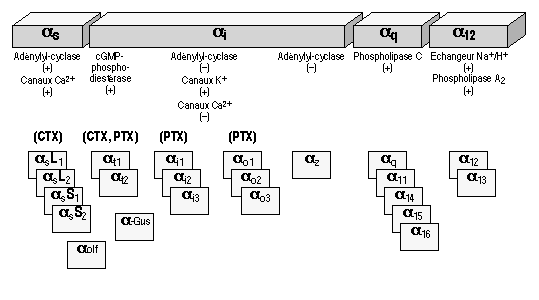 La classe Gsa ("s" pour : stimulant l'adénylate cyclase) est composée de quatre types de sous-unités Gs, issues d'un épissage alternatif, et de la protéine Golf, spécifique de l'épithélium olfactif. La classe Gi/oa ("i" pour : inhibant l'adénylate cyclase) comporte les deux types de transducine Gt1 et Gt2 (des cellules en bâtonnet et en cône de la rétine), trois sous-unités Gi, trois sous-unités Go ("o" pour : other) et la sous-unité Gz. La classe Gq/11a est constituée de Gq, G11, G14, G15, G16 La classe G12a, enfin, est formée des sous unités G12 et G13. 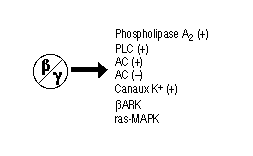 Il a pu être mis en évidence que le dimère b/g peut lui aussi activer ou inhiber l'activité de certains effecteurs comme certaines adénylates cyclases, des canaux ioniques, ou encore la voie ras-MAP kinases. 7 - Variété des effecteurs, cibles des protéines-G : Les adénylates cyclases (ou adénylyl-cyclases) : Il existe à ce jour 9 isoformes connues de l'adénylate cyclase (AC). C'est une enzyme membranaire, avec 12 régions transmembranaires, qui est activée par les sous-unités de type Gsa et inhibée par celles de type Gia. L'AC catalyse la réaction de formation de l'AMPc, qui est le second messager produit, à partir d'ATP. Cet AMPc est l'activateur de la protéine kinase A (PKA) qui est capable de phosphoryler, et ainsi de moduler l'activité, de nombreux substrats protéiques. La phospholipase C : La phospholipase C est une enzyme catalysant la réaction d'hydrolyse du PIP2 (phosphatidyl inositol bis-phosphate) en IP3 (inasitol-3-phosphate) et DAG (diacylglycérol). Elle est activée par les sous-unités de la classe Gqa L'IP3 est le messager secondaire qui agit au niveau de récepteurs spécifiques, situés à la membrane de compartiments vésiculaires intracellulaires, entraînant un relargage à l'intérieur du cytosol, des ions calcium contenus dans ces vésicules. Le DAG quant à lui, active la protéine kinase C, qui, elle aussi et tout comme la protéine kinase A, est capable de phosphoryler des protéines, afin d'en moduler l'activité. La cGMP phosphodiestérase : Cest l'enzyme spécifique des cellules en bâtonnet et en cône de la rétine, qui catalyse la réaction de formation du GMPc à partir du GTP. Elle est activée par les transducines Gt1 et Gt2. Les canaux ioniques : Certains canaux à conductance potassique ou calcique voient leur activité modulée par certaines sous-unités de la classe Gia. 8 - Désensibilisation de la réponse induite par l'agoniste : Il existe quatre grand mécanisme qui permettent de terminer le signal apporté par le stimulus extracellulaire : a) La régulation de la concentration en agoniste : 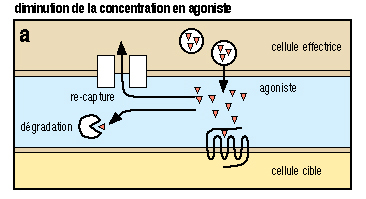 Lorsque le ligand est relargué dans une fente synaptique comme c'est le cas dans la figure ci-dessus, très souvent, deux mécanismes entraînent une diminution de la concentration synaptique en agoniste : il s'agit de la re-capture présynaptique et de la dégradation de l'agoniste par des enzymes spécifiques (exemple : acétylcholine et acétylcholinestérase). b) Le découplage fonctionnel par phosphorylation : 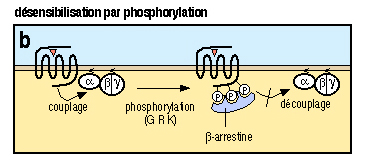 L'activation d'un RCPG active les protéines-G intracellulaires. Ce couplage est peu à peu inhibé, car on assiste à une phosphorylation de la région intracellulaire du récepteur qui est responsable de l'activation des protéines-G. Les enzymes responsables de cette phosphorylation sont des GRK : G-protein coupled receptor kinases. La bARK (beta adrenergic receptor kinase) est une enzyme spécifique des récepteurs b-adrénergiques, appartenant à la famille des GRKs. Le récepteur phosphorylé est reconnu par des protéines de type arrestine qui se lient au récepteur et le rendent incapable d'activer l'échange GDP-GTP au niveau des protéines-G c) L'internalisation du complexe ligand-récepteur 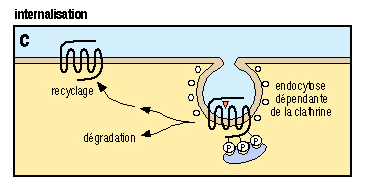 Les mécanismes de phosphorylation des RCPGs et de liaison de l'arrestine sont suivis par une internalisation du complexe ligand-récepteur phosphorylé, à l'intérieure de vésicules recouvertes de clathrine. Les récepteur ainsi endocytosés peuvent alors soit subir un recyclage à la membrane plasmique (ce qui nécessite une déphosphorylation du récepteur et une élimination du ligand), soit subir une dégradation, avec la fusion des vésicules d'endocytose avec les lysozomes. d) La régulation négative du nombre total de récepteurs à la surface cellulaire, ou down regulation. 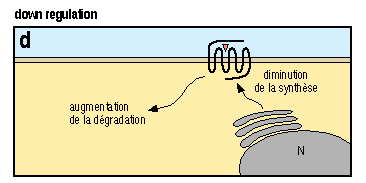 Lors d'une exposition longue, chronique, à un ligand agoniste, on peut observer une diminution du nombre total de révepteurs à la surface cellulaire. Deux phénomènes sont impliqués dans la down regulation : une diminution de la synthèse de récepteurs et une augmentation de sa dégradation. |